Antibiorésistance et nouveaux antibiotiques
Compte-rendu:
Dre Corina Ringsell
Rédactrice
Revue:
Pre Dre méd. Nina Khanna
Université et Hôpital universitaire de Bâle
E-mail: nina.khanna@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’antibiorésistance est un problème croissant et a été directement responsable d’environ 1,3 million de décès dans le monde en 2019.1 La Pre Dre méd. Nina Khanna de l’Université et de l’Hôpital universitaire de Bâle a expliqué la situation épidémiologique en Suisse, les mesures nécessaires pour prévenir l’antibiorésistance et les nouveaux médicaments sur lesquels reposent désormais les espoirs.
Keypoints
-
L’antibiorésistance est en augmentation dans le monde entier.
-
Pour prévenir ou combattre les agents pathogènes «multiple drug resistant» (MDR), il faut élaborer des concepts à plusieurs niveaux.
-
L’«Antibiotic Stewardship» est un aspect essentiel.
-
Malgré les progrès réalisés dans le développement de nouveaux antimicrobiens, il est difficile de trouver des agents ayant une action sélective contre les agents pathogènes MDR.
-
Actuellement, il existe un «unmet medical need» pour de nouveaux médicaments dirigés contre les agents pathogènes à Gram négatif résistants.
-
Des voies de développement efficaces sont nécessaires pour les agents bactéricides conventionnels et non conventionnels dans les processus de fabrication, d’essais cliniques et d’autorisation.
-
Des difficultés surviennent lors de la conception optimale d’études, de la sélection et du recrutement de la population cible pertinente.
L’infectiologue a commencé sa présentation avec le cas d’une patiente de 84 ans, transférée d’une clinique gériatrique à l’Hôpital universitaire de Bâle pour un choc septique. Le traitement empirique par pipéracilline et tazobactam n’a apporté aucune amélioration. L’hémoculture a révélé la présence de l’agent pathogène produisant des carbapénémases Klebsiella pneumoniae. L’antibiogramme a révélé une résistance à tous les antibiotiques testés, à l’exception du cotrimoxazole. L’analyse moléculaire a mis en évidence plusieurs types de carbapénémases/d’ESBL. La patiente est décédée dans les quatre heures qui ont suivi. Dans un tel cas, la question se pose de savoir si on fait face à un changement dans l’épidémiologie, a déclaré N.Khanna. La patiente ne serait pas allée à l’étranger, aurait passé la majeure partie de sa vie chez elle et les derniers mois à la clinique gériatrique.
Une étude réalisée en 2023 a montré qu’un lien clair avec une zone d’endémie n’a pu être établi que dans 62% des cas de bactéries produisant des carbapénémases, et souvent sans lien réel.2
Épidémiologie en Suisse
En 2015, plus de 7100 cas d’infections dues à des bactéries résistantes aux antibiotiques ont été recensés en Suisse, dont 276 ont entraîné le décès.3 N. Khanna a présenté les données d’ANRESIS (www.anresis.ch) illustrant la situation nationale actuelle. Au cours des vingt dernières années, la proportion d’E.coli résistante aux fluoroquinolones (FQR-E.coli) a presque doublé (20%) et la proportion d’E.coli résistante aux céphalosporines à spectre élargi (ESCR-E. coli) a même quintuplé (12–15%). En revanche, les pourcentages de bactéries à Gram positif résistantes, telles que Streptococcus pneumoniae résistant à la pénicilline (PNSP) et Staphylococcus aureus résistant à la méthicilline (MRSA), ont légèrement diminué. Les entérocoques résistants à la vancomycine (VRE) se situent à un niveau bas avec de petits pics.4
Parmi les agents pathogènes résistants aux carbapénèmes, les Klebsiella pneumoniae sont actuellement les plus répandus, avec un taux plus élevé en Suisse romande, notamment à Genève, et dans la région de Zurich.5
Causes de l’antibiorésistance et mesures pour y remédier
Les causes du développement de l’antibiorésistance sont principalement les suivantes:
-
prescription trop fréquente/incorrecte d’antibiotiques,
-
prise incorrecte par les patient·es,
-
utilisation inutile d’antibiotiques dans le secteur de l’agriculture,
-
prévention et contrôle inadéquats des infections dans le secteur de la santé,
-
manque de mesures d’hygiène,
-
absence de diagnostic permettant d’identifier les agents pathogènes.
Les causes de l’antibiorésistance sont aussi variées que les mesures pour y remédier. Dans sa présentation, N. Khanna a abordé deux aspects particulièrement importants: l’«Antibiotic Stewardship» et le développement de nouvelles substances.
Antibiotic Stewardship
L’«Antibiotic Stewardship» (ABS) est l’utilisation rationnelle et responsable des antibiotiques dans le but de traiter au mieux les patient·es tout en prévenant le développement de processus de sélection et de résistance chez les bactéries.
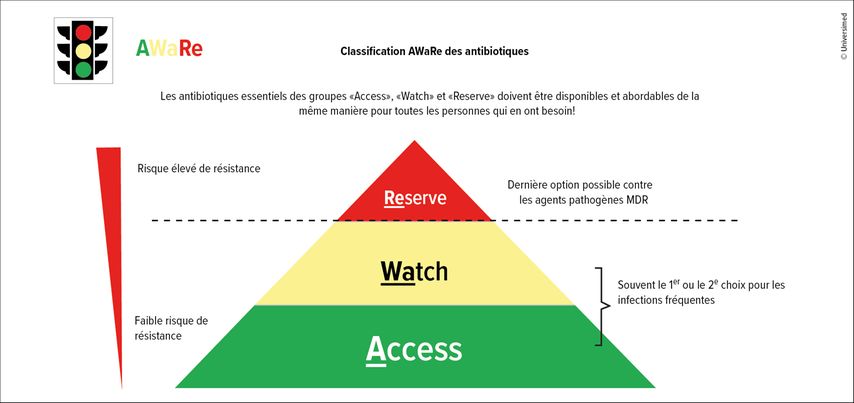
Une étude menée dans 76 pays a toutefois montré que la prise d’antibiotiques avait augmenté d’environ 65% entre 2000 et 2015, surtout dans les pays à faible revenu et à revenu intermédiaire.6 Pour faciliter le choix des substances appropriées, l’OMS a utilisé le schéma AWaRe pour classer les antibiotiques disponibles (Fig. 1). «Access» comprend les substances présentant un faible risque de résistance, «Watch» regroupe les antibiotiques qui sont également souvent utilisés à l’hôpital, tandis que «Reserve» comprend les médicaments à risque élevé de résistance, réservés à des cas sélectionnés en dernier recours. Pour les infections les plus fréquentes, l’OMS estime que seuls les médicaments des deux premiers groupes devraient être utilisés, surtout ceux du groupe «Access».7 Une étude européenne a cherché à savoir si cela était appliqué de cette manière. Elle a montré non seulement qu’il existe de grandes différences dans l’utilisation des antibiotiques à travers l’Europe, mais aussi que certains pays prescrivent une proportion particulièrement élevée d’antibiotiques du groupe «Access», par exemple le Danemark et la France.7
Avant d’utiliser un antibiotique, il faut toujours se demander s’il est vraiment indiqué, a souligné l’infectiologue. En cas d’otite moyenne, de bronchite, de sinusite, de pharyngite non compliquées, de bactériuries asymptomatiques et d’inflammations des voies urinaires non compliquées, aucun antibiotique n’est en effet nécessaire.8 Pourtant, les antibiotiques sont encore trop souvent prescrits pour ces troubles, même en Suisse, a-t-elle déclaré.9
«Si un antibiotique est indiqué, il faut bien réfléchir à celui qui est le mieux adapté et à quelle dose», a souligné N.Khanna. Si possible, il doit être administré par voie orale et sur une durée aussi courte que nécessaire.
Agents pathogènes multirésistants et nouveaux médicaments
L’OMS a mis à jour la liste des bactéries pour lesquelles de nouveaux antibiotiques sont nécessaires de toute urgence.10 Actuellement, l’agent pathogène résistant aux carbapénémases Acinetobacter baumannii et les Enterobacterales font partie du groupe de priorité critique («critical»). Dans le groupe de priorité élevée («high»), on trouve entre autres Enterococcus faecium et Staphylococcus aureus. Pseudomonas aeruginosa est passé du groupe de priorité critique à élevée.10
Dans la pratique clinique quotidienne, les mutations les plus fréquentes entraînant une résistance concernent les bactéries à Gram négatif produisant des β-lactamases.11 «Pour les Enterobacterales, il s’agit principalement de pénicillinases (p.ex. TEM 1, SHV 1), d’ESBL comme CTX-M (>90% de tous les types d’ESBL), d’AmpC et de carbapénémases», a expliqué N.Khanna.
«Extended spectrum β-lactamases» (ESBL)
Les agents pathogènes ESBL-positifs sont sensibles aux carbapénèmes et répondent presque toujours à la nitrofurantoïne et à la fosfomycine, souvent aussi au cotrimoxazole et à la ciprofloxacine.12 Les E.coli et Klebsiella pneumoniae ESBL se sont fortement répandues en Europe au cours des vingt dernières années et représentent jusqu’à 50% des isolats invasifs.13
Selon l’infectiologue, les bactéries ESBL-positives peuvent certes être traitées par des carbapénèmes, mais l’objectif est toutefois de les économiser. De nouvelles substances actives sont donc en cours de développement. Les associations céfépime/taniborbactam, céfépime/enmétazobactam et sublactam/durlobactam (toutes en phaseIII) sont déjà en très bonne voie.
Bactéries produisant des carbapénémases
À l’aide d’un rapport de cas, N.Khanna a présenté les problèmes de résistance des agents pathogènes produisant des carbapénémases. Avant d’arriver en Suisse, le patient avait été hospitalisé en Pologne pour un urosepsis et une infection à Klebsiella pneumoniae avait été détectée. À l’Hôpital universitaire de Bâle, l’homme a d’abord reçu un traitement empirique par l’ertapénem par voie intraveineuse et une culture d’urine a été réalisée. L’analyse moléculaire a montré qu’il s’agissait d’une souche de la bactérie produisant des métallo-β-lactamases (MBL), qui était résistante à tous les antibiotiques testés. Les directives de l’Infectious Diseases Society of America (IDSA) et de l’European Society of Clinical Microbiology and Infectious Diseases (ESCMID) recommandent dans de tels cas le céfidérocol ou l’association ceftazidime/avibactam plus aztréonam.14,15
Contrairement aux antibiotiques β-lactamines, le céfidérocol contourne les mécanismes de résistance en utilisant non seulement les canaux porines pour pénétrer dans la cellule bactérienne, mais aussi son système de transport du fer. Il s’y lie aux protéines de liaison aux pénicillines (PBP) et a ainsi un effet bactéricide. Il ne peut pas être dégradé par les β-lactamases et empêche son transport hors de la cellule en modifiant la pompe d’efflux. Le céfidérocol est efficace contre trois agents pathogènes appartenant au groupe de priorité élevée et critique dans la liste de l’OMS, à savoir Pseudomonas, Acinetobacter et Enterobacterales.16
Dans une étude portant sur 150 participant·es, la substance a été comparée au meilleur traitement disponible. Il s’est avéré que le céfidérocol était aussi efficace que le traitement de comparaison, mais qu’il entraînait davantage de décès (34% par rapport à 18%).17 Cependant, cela n’a pas été observé dans une série de cas à l’Hôpital universitaire de Bâle. D’autres études n’ont pas non plus montré d’augmentation du nombre de décès sous céfidérocol.18
L’agent pathogène s’est toutefois également révélé résistant au céfidérocol dans le cas présenté par N.Khanna, seules la fosfomycine et la tigécycline étaient encore efficaces. Un test de synergie a alors été effectué pour l’association ceftazidime/avibactam plus aztréonam, qui a donné un «Fractional Inhibitory Concentration Index» (FICI) de 0,06. Avec un FICI ≤0,5, on part du principe qu’il y a une synergie. L’association aurait donc pu être une alternative. Un traitement par la fosfomycine a toutefois été instauré.
Un problème particulier: Acinetobacter baumannii résistant aux carbapénèmes
Selon N.Khanna, cet agent pathogène n’est pas encore très répandu en Suisse à ce jour. La gestion est toutefois complexe, a-t-elle ajouté. D’une part, il est souvent difficile de différencier une colonisation d’une infection, et les infections sont souvent le résultat d’une colonisation. D’autre part, Acinetobacter baumannii a développé de multiples mécanismes de résistance, dont les MBL et différentes carbapénémases. Il n’existe aucune norme de traitement uniforme à ce jour. Les directives recommandent l’association ampicilline/sulbactam, ou en alternative la tigécycline ou les polymyxines.14,15
Un nouveau médicament contient l’association sulbactam/durlobactam. Il a été comparé à la colistine dans les pneumonies sévères à Acinetobacter baumannii dans l’étude ATTACK. L’association n’était pas inférieure à la colistine, elle s’accompagnait au contraire de taux de guérison clinique plus élevés, d’un meilleur résultat microbiologique et d’une néphrotoxicité moindre.19 Le médicament est déjà autorisé aux États-Unis, mais pas encore en Suisse.
Entérocoques résistants à la vancomycine
Dans le cas de la résistance à la vancomycine, la structure de la paroi de la cellule bactérienne se modifie et la substance ne peut plus s’y lier.20 Les entérocoques résistants à la vancomycine (VRE) ont certes une faible pathogénicité, mais ils peuvent provoquer des infections sévères chez les patient·es à risque, par exemple immunodéprimé·es ou en soins intensifs, a souligné l’infectiologue. En outre, de plus en plus de VRE présentant une sensibilité moindre à la daptomycine sont isolés en Suisse. Dans de tels cas, le traitement par le linézolide est recommandé, a-t-elle expliqué.
Ce qui est actuellement en cours de développement
«Malheureusement, il faut dire que relativement peu de substances sont en cours de développement», a déclaré N.Khanna. Actuellement, 76 antimicrobiens sont à différents phases de développement. Parmi eux, 41 sont dirigés contre des pathogènes appartenant au groupe de priorité critique dans la liste de l’OMS, 16 contre des mycobactéries, 15 contre Clostridium difficile et 4 sont des agents à large spectre.21
Selon N.Khanna, la nouvelle association céfépime/zidébactam dirigée contre Pseudomonas aeruginosa produisant des MBL est particulièrement intéressante. La particularité serait la forte inhibition des β-lactamases et l’effet bactéricide grâce à la forte affinité de liaison à PBP2.22
Source:
Congrès de printemps de la SSMIG, du 29 au 31 mai 2024, Bâle
Littérature:
1 Antimicrobial Resistance Collaborators: Lancet 2022; 399: 629-55 2 Vock I et al.: Infect Control Hosp Epidemiol 2023; 44: 1959-65 3 Gasser M et al.: Lancet Infect Dis 2019; 19: 17-8 4 https://www.bag.admin.ch/bag/de/home/krankheiten/infektionskrankheiten-bekaempfen/antibiotikaresistenzen/wie-entwickelt-sich-die-antibiotikaresistenzlage---.html 5 www.anresis.ch/antibiotic-resistance resistance-data-human-medicine 6 Klein EY et al.: PNAS 2018; 115: E3463-70 7 Moja L et al.: Clin Microbiol Infect 2024: 30 Suppl 2: S1-51 8 www.biham.unibe.ch/research/tools_to_facilitate_shared_decision_making/index_eng.html 9 Glinz D et al.: J Antimicrob Chemother 2017; 72: 3205-12 10 www.who.int/publications/i/item/9789240093461 11 Peleg AY et al.: N Engl J Med 2010; 362: 1804 13 12 Jacoby GA et al.: N Engl J Med 2005; 352: 380 13 Antimicrobial resistance in the EU/EEA (EARS-Net): www.ecdc.europa.eu/sites/default/files/documents/AER-antimicrobial-resistance.pdf 14 Tamma PD et al: Clin Infect Dis 2024: ciae403 (doi: 10.1093/cid/ciae403) 15 Mical P et al.: Clin Microbiol Infect 2022; 28: 521-47 16 Wang H, Palasik BN: Ther Adv Urol 2022; doi: 10.1177/175628722 11065570 17 Bassetti M et al.: Lancet Infect Dis 2021; 21: 226-40 18 Zingg S et al.: Open Forum Infect Dis 2020; 7: ofaa185 19 Kaye KS et al.: Lancet Infect Dis 2023; 23: 1072-84 20 Murray BE: N Engl J Med 2000; 342: 710-21 21 Butler MS et al.: Antimicrob Agents Chemother 2022; 66: e0199121 22 Dubey D et al.: Ann Clin Microbiol Antimicrob 2023; 22: 55
Das könnte Sie auch interessieren:
Le diabète de type 2 peut être prévenu
Une activité physique accrue, un changement des habitudes alimentaires et une perte de poids réduisent le risque de diabète ou peuvent même conduire à une rémission du diabète de type 2 ...
Points forts de l’ESC sur l’amylosecardiaque
La simplification de l’algorithme diagnostique, le renforcement de l’attention portée à la maladie et l’énorme augmentation du nombre d’options thérapeutiques ont permis des progrès ...
Sarcopénie chez les patient·es atteint·es de cirrhose
La sarcopénie est une maladie musculaire progressive qui s’accompagne d’une perte de masse et de fonction musculaires. Bien qu’environ un tiers des patient·es atteint·es de cirrhose ...