HBV-Reaktivierung unter Immunsuppression
Autorin:
Dr. Caroline Schwarz
4. Medizinische Abteilung,
Gastroenterologie & Hepatologie
Klinik Ottakring
Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Durch rezente Migrationsdynamiken befindet sich auch in Österreich die Prävalenz der Infektion mit dem Hepatitis-B-Virus (HBV) im Steigen. Besonders bei Patient:innen unter Immunsuppression ist daher auf eine mögliche Reaktivierung zu achten. Mittels prophylaktischer Immunisierung sowie medikamentöser Therapie kann der HBV-Reaktivierung jedoch entgegengewirkt werden.
Keypoints
-
Vor Immunsuppression ist die Bestimmung des HBV-Status mittels Serologie obligat.
-
Bei HBV-Naivität ist die Impfung indiziert.
-
Eine Prophylaxe der HBV-Reaktivierung ist angezeigt bei Patient:innen mit HBsAg+/HBV-DNA+ bzw. bei Patient:innen mit antiHBc+ und hohem Risiko einer Reaktivierung.
Einleitung
Rund 240 Millionen Menschen weltweit sind mit dem Hepatitis-B-Virus (HBV) infiziert (HBsAg+), knapp ein Drittel der Weltbevölkerung weist serologische Zeichen einer bestehenden bzw. stattgefundenen Infektion auf.1,2 Die Verfügbarkeit der HBV-Impfung, Zugang zu antiviraler Therapie sowie sozioökonomische Faktoren beeinflussen dabei die lokale HBV-Prävalenz und führen zu relevanten geografischen Unterschieden in der Epidemiologie. Innerhalb der autochthonen österreichischen Bevölkerung ist die HBV-Prävalenz insgesamt niedrig (<2%), durch rezente Migrationsdynamiken zeigen jedoch bestimmte Populationen auch in Niedrigprävalenzländern teilweise deutlich höhere Prävalenzen.3,4
Gleichzeitig finden immunsuppressive bzw. immunmodulatorische Therapien immer mehr Anwendung in verschiedenen Fachbereichen der Medizin und sind längst nicht mehr auf onkologische bzw. transplantationsmedizinische Indikationen limitiert.5–8
Menschen, bei denen Zeichen einer durchgemachten (HBsAg–/antiHBc+ und/oder antiHBs+) bzw. einer bestehenden (HBsAg+) HBV-Infektion vorhanden sind, können aufgrund der Persistenz der cccDNA des Hepatitis-B-Virus in den Hepatozyten unter Immunsuppression jedoch eine potenziell lebensbedrohliche HBV-Reaktivierung (HBVr) erfahren.9
Definition der HBVr
In der Literatur gibt es keine einheitliche Definition der HBVr, die generellen Konzepte sind jedoch insgesamt ähnlich:10 Bei Patient:innen mit chronischer HBV-Infektion (HBsAg+ für ≥6 Monate und HBV-DNA+) definiert sich die HBVr durch einen Anstieg der HBV-DNA gegenüber der Baseline, wobei die hepatologischen Fachgesellschaften hier keine einheitlichen quantitativen Referenzwerte angeben.9–12 Bei durchgemachter HBV-Infektion (HBsAg– und antiHBc+) besteht eine HBVr, wenn HBV-DNA und/oder HBsAg+ (Seroreversion) im Blut detektierbar werden.10,13 Eine HBVr wird häufiger unter Immunsuppression beobachtet, kann jedoch auch spontan auftreten.5,13–16
Risikostratifizierung
Die Möglichkeit einer HBVr unter Immunsuppression ergibt sich durch die Persistenz der cccDNA des Hepatitis-B-Virus in den Hepatozyten.11,16–18 Im Rahmen einer Reduktion bzw. eines Verlustes der körpereigenen immunologischen Kontrolle kann das Virus auf Basis der cccDNA neuerlich replizieren. Das Risiko einer HBVr hängt dabei einerseits vom HBV-Status des Patienten bzw. der Patientin vor Immunsuppression ab (chronische HBV-Infektion/Hepatitis [HBsAg+] vs. durchgemachte HBV-Infektion [HBsAg–]), andererseits von der Art der Immunsuppression.7,10,11,16,19,20
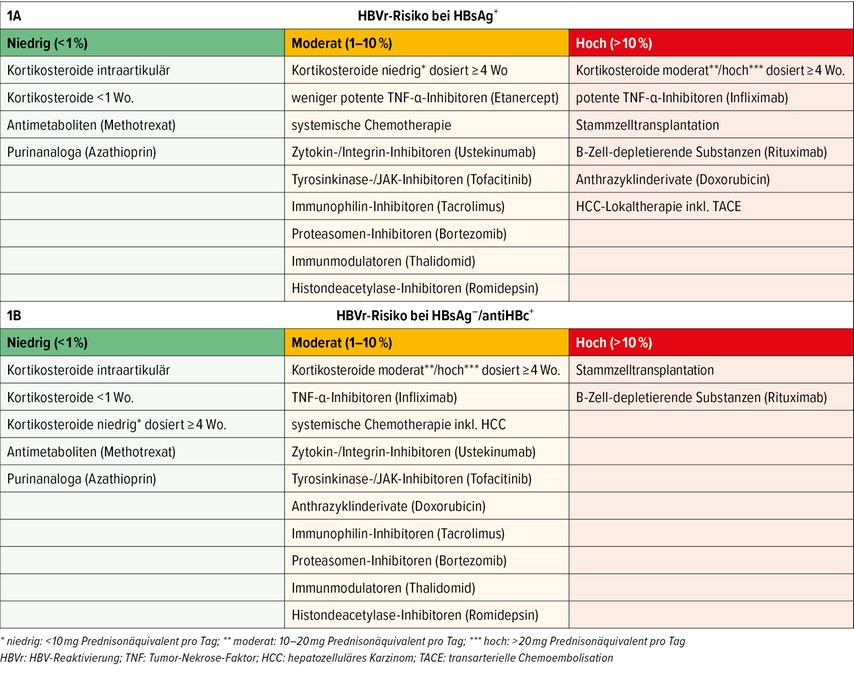
Während das HBVr-Risiko im Rahmen einer Immunsuppression bei HBsAg+-Patient:innen, insbesondere bei HBeAg+ und/oder hoher HBV-DNA-Viruslast, generell erhöht ist, richtet sich die Wahrscheinlichkeit einer HBVr bei HBsAg–-Patient:innen mit durchgemachter HBV-Infektion nach der Art der Immunsuppression.9,16 Je nach Ursache bzw. Substanzklasse, die zur Immunsuppression führt, erfolgt die Einteilung in hohes (>10%), moderates (1–10%) bzw. niedriges (<1%) HBVr-Risiko (Abb. 1).11,19,20
Abb. 1: Risikostratifizierung unterschiedlicher Immunsuppressiva in Bezug auf das Auftreten einer HBV-Reaktivierung, A: bei HBsAg+-Patient:innen, B: bei HBsAg–/antiHBc+-Patient:innen (modifiziert nach Morillas RM, López Sisamón D 2019; Choi J, Lim YS 2017; Loomba R, Liang TJ 2017; Smalls DJ et al. 2019; Perrillo RP et al. 2015)9,13,15,16,19
Wirtsfaktoren wie hämatologische Grunderkrankungen und männliches Geschlecht führen zusätzlich zu einer Erhöhung des HBVr-Risikos.16,21,22
Klinischer Verlauf
Eine HBVr kann je nach Grunderkrankung, Art der Immunsuppression und wirtsspezifischen Faktoren im gesamten Verlauf einer Immunsuppression auftreten, oft wird sie jedoch erst nach längerer Therapiedauer bzw. ggf. sogar erst nach Beendigung der immunsuppressiven Therapie beobachtet.9
Initial bestehen im Rahmen einer HBVr meist keine klinischen Symptome. Bei HBsAg+-Patient:innen kommt es während dieser Phase zu einem raschen Anstieg der HBV-DNA, gefolgt von einem Transaminasenanstieg.10,12
Anfangs HBsAg–-Patient:innen entwickeln in dieser Phase eine Seroreversion mit HBsAg-Positivität, in der Folge kommt es ebenfalls zum HBV-DNA-Anstieg und zur Transaminasenauslenkung.10,12 Meist bleiben Patient:innen mit HBVr auch im weiteren Verlauf asymptomatisch, gelegentlich werden Abgeschlagenheit, rechtsseitige Oberbauchschmerzen oder Ikterus beobachtet.9 Eine Aggravierung des klinischen Bildes mit Koagulopathie, Aszites und hepatischer Enzephalopathie im Sinne eines akuten Leberversagens ist möglich und geht mit einer deutlich erhöhten Mortalität einher.15,17,23
Prophylaxe der HBVr
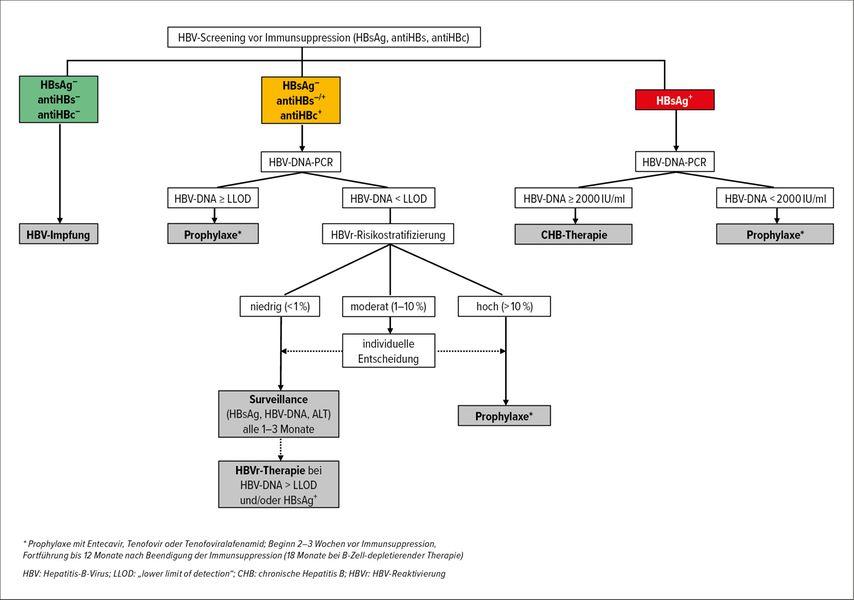
Aufgrund des potenziell fulminanten Verlaufs einer HBVr unter Immunsuppression kommt der zeitgerechten Prophylaxe eine essenzielle Bedeutung zu. Seitens der European Association for the Study of the Liver wird die Bestimmung HBV-spezifischer Seromarker (HBsAg, antiHBs, antiHBc; quantitative HBV-DNA bei HBsAg+ und/oder antiHBc+) vor Einleitung jeder immunsuppressiven Therapie sowie bei Diagnosestellung einer HIV-Infektion empfohlen (Abb. 2).11
Abb. 2: Algorithmus zur Indikationsevaluation einer HBVr-Prophylaxe (modifiziert nach Morillas RM, López Sisamón D 2019; EASL 2017)9,11
HBV-naive (HBsAg/antiHBs/antiHBc negativ) Patient:innen sollten so früh wie möglich eine vollständige HBV-Immunisierung erhalten.9,13,20
Bei HBsAg+-Patient:innen sind eine hepatologische Vorstellung und eine Therapie bzw. Prophylaxe mit Entecavir (ETV), Tenofovirdisoproxil (TDF) oder Tenofoviralafenamid (TAF) indiziert. Die hepatologische Evaluation sollte nach Möglichkeit rechtzeitig vor Beginn der Immunsuppression erfolgen, eine notwendige immunsuppressive Therapie darf sich dadurch allerdings nicht verzögern.
Bei Patient:innen mit Zeichen einer stattgefundenen HBV-Exposition richtet sich die Indikation einer antiviralen HBV-Reaktivierungsprophylaxe nach der HBV-DNA-Viruslast sowie der Art der geplanten Immunsuppression (Abb.1,2).7,10,11,16,20
Therapie der HBVr
Bei rechtzeitiger Diagnose und Behandlung einer HBVr kann meist eine rasche Reduktion der HBV-Viruslast erzielt werden.9,10,13–15 Auch eine spontane HBV-DNA-Suppression ist möglich – sofern eine solche auftritt, wird sie aber typischerweise im Zusammenhang mit der Beendigung der Immunsuppression beobachtet.9,17 Bei Patient:innen, die bereits ein akutes HBVr-assoziiertes Leberversagen entwickelt haben, ist die Wahrscheinlichkeit einer spontanen virologischen Kontrolle äußerst gering.9,17,23
Wird eine HBVr unter Immunsuppression diagnostiziert, ist umgehend eine antivirale Therapie mit ETV, TDF oder TAF indiziert.11 HIV-infizierte Patient:innen sollten ein HBV-wirksames antiretrovirales Therapieregime erhalten.11 Im Falle einer laufenden immunsuppressiven bzw. immunmodulatorischen Therapie sollte eine strenge Nutzen-Risiko-Abwägung erfolgen und die entsprechende Substanz nach Möglichkeit abgesetzt werden.
Fazit
Eine HBVr unter Immunsuppression kann zu einem akuten Leberversagen mit lebensbedrohlichem Verlauf führen. Vor Einleitung einer immunsuppressiven bzw. immunmodulatorischen Therapie sowie bei Diagnosestellung einer HIV-Infektion ist die Bestimmung des HBV-Serostatus daher obligat. Da bei der Indikationsabwägung einer HBVr-Prophylaxe virologische, medikamentöse und wirtsspezifische Faktoren beachtet werden müssen, ist eine individuelle Evaluation essenziell. HBV-naive Patient:innen sollten rechtzeitig vor Immunsuppression eine HBV-Immunisierung erhalten, bei HBsAg+-Patient:innen ist eine antivirale Therapie bzw. Prophylaxe indiziert. In Anbetracht der exzellenten Verträglichkeit moderner antiviraler Substanzen sowie des potenziell fulminanten Verlaufes im Falle einer HBVr ist bei Patient:innen mit St.p. HBV-Exposition und unklarem HBVr-Risiko, insbesondere bei Therapie mit mehreren immunsuppressiven Substanzen, unter Abwägung der Komorbiditäten eine großzügige Indikationsstellung für eine HBVr-Prophylaxe zu empfehlen.
Literatur:
1 Schweitzer A et al.: Estimations of worldwide prevalence of chronic hepatitis B virus infection: a systematic review of data published between 1965 and 2013. Lancet 2015; 386(10003): 1546-55 2 Trépo C et al.: Hepatitis B virus infection. Lancet 2014; 384(9959): 2053-63 3 Coppola N et al.: Hepatitis B virus, hepatitis C virus and human immunodeficiency virus infection in undocumented migrants and refugees in southern Italy, January 2012 to June 2013. Euro Surveill 2015; 20(35): 30009 4 Schmidbauer C et al.: Epidemiological trends of HBV and HDV coinfection among Viennese HIV+ patients. Liver Int 2021; 41(11): 2622-34 5 Baumert LS et al.: HBV reactivation and clinical resolution in an isolated anti-HBc-positive patient during immune checkpoint inhibition. Med 2024; 5(2): 126-31.e1 6 Chen LF et al.: Short-course tocilizumab increases risk of hepatitis B virus reactivation in patients with rheumatoid arthritis: a prospective clinical observation. Int J Rheum Dis 2017; 20(7): 859-69 7 Fukuda W et al.: Risk stratification and clinical course of hepatitis B virus reactivation in rheumatoid arthritis patients with resolved infection: final report of a multicenter prospective observational study at Japanese Red Cross Hospital. Arthritis Res Ther 2019; 21(1): 255 8 Lan TY et al.: Risk of hepatitis B virus (HBV) reactivation in HBsAg-negative, anti-HBc-negative patients receiving rituximab for autoimmune diseases in HBV endemic areas. Gut Liver 2023; 17(2): 288-98 9 Morillas RM, López Sisamón D: Reactivation of hepatitis B associated with immunosuppressants and chemotherapy. Natural history, risk factors and recommendations for prevention. Med Clin (Barc) 2019; 152(3): 107-14 10 Myint A et al.: Reactivation of hepatitis B virus: a review of clinical guidelines. Clin Liver Dis 2020; 15(4): 162-7 11 European Association for the Study of the Liver: EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol 2017; 67(2): 370-98 12 Hoofnagle JH: Reactivation of hepatitis B. Hepatology 2009; 49(5): 156-65 13 Choi J, Lim YS: Characteristics, prevention, and management of hepatitis B virus (HBV) reactivation in HBV-infected patients who require immunosuppressive therapy. J Infect Dis 2017; 216(8): 778-84 14 Bessone F, Dirchwolf M: Management of hepatitis B reactivation in immunosuppressed patients: an update on current recommendations. World J Hepatol 2016; 8(8): 385-94 15 Loomba R, Liang TJ: Hepatitis B reactivation associated with immune suppressive and biological modifier therapies: current concepts, management strategies, and future directions. Gastroenterology 2017; 152(6): 1297-309 16 Smalls DJ et al.: Hepatitis B virus reactivation: risk factors and current management strategies. Pharmacotherapy 2019; 39(12): 1190-203 17 Anastasiou OE et al.: Clinical and virological aspects of HBV reactivation: a focus on acute liver failure. Viruses 2019; 11(9): 863 18 Yeo W, Chan HLY: Hepatitis B virus reactivation associated with anti-neoplastic therapy. J Gastroenterol Hepatol 2013; 28(1): 31-7 19 Perrillo RP et al.: American Gastroenterological Association Institute technical review on prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy. Gastroenterology 2015; 148(1): 221-44.e3 20 Reddy KR et al.: American Gastroenterological Association Institute guideline on the prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy. Gastroenterology 2015; 148(1): 215-9, quiz e16-17 21 Cheng AL et al.: Steroid-free chemotherapy decreases risk of hepatitis B virus (HBV) reactivation in HBV-carriers with lymphoma. Hepatology 2003; 37(6): 1320-8 22 Yeo W et al.: Hepatitis B virus reactivation in lymphoma patients with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab. J Clin Oncol 2009; 27(4): 605-11 23 Zhu Y et al.: Hepatitis B virus reactivation increased the risk of developing hepatic failure and mortality in cirrhosis with acute exacerbation. Front Microbiol 2022; 13: 910549
Das könnte Sie auch interessieren:
OP-Freigabe bei Leberzirrhose
Patient:innen mit Leberzirrhose haben ein erhöhtes Risiko für Komplikationen und eine erhöhte Mortalität – daher muss eine detaillierte präoperative Evaluierung erfolgen. Es stehen ...
Die erste internationale multidisziplinäre MASLD-Leitlinie 2024
Die neue europäische Leitlinie zum Management der mit metabolischer Dysfunktion assoziierten steatotischen Lebererkrankung (MASLD) gibt detaillierte Empfehlungen zu Diagnose, Behandlung ...
Top-Papers Hepatologie
Ganz im Sinne des Titels der Veranstaltung wurden auch beim diesjährigen Update Gastroenterologie-Stoffwechsel vom 14. bis 16. November 2024 in Innsbruck aktuelle Themen der ...