Covid-19 und Niere: Was haben wir aus einem Jahr Pandemie gelernt?
Autoren:
Univ.-Prof. Dr. Michael Joannidis
Dr. Timo Mayerhöfer
Dr. Sebastian Klein
Internistische Intensiv- und Notfallmedizin
Department Innere Medizin
Medizinische Universität Innsbruck
E-Mail: michael.joannidis@i-med.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mittlerweile ist weitgehend bekannt, dass sich SARS-CoV-2 nicht nur auf das respiratorische System beschränkt, sondern auch zahlreiche andere Organe befallen kann. Hierzu zählt auch die Niere, die besonders häufig bei kritisch kranken Covid-19-Patienten im Rahmen einer akuten Nierenschädigung betroffen ist. Neben der Erkrankung selbst kommen hierfür auch Nebeneffekte der notwendigen intensivmedizinischen Maßnahmen als auslösende Faktoren infrage.
Keypoints
-
Die Inzidenz von akuten Nierenschädigungen (AKI) bei intensivmedizinisch betreuten Covid-19-Patienten reicht bis zu 50%.
-
Die Niere kann direkt durch viralen Befall oder indirekt durch die Reaktion auf die SARS-CoV-2-getriggerte Immunantwort in Mitleidenschaft gezogen werden.
-
Weitere die Nierenfunktion beeinflussende Faktoren sind die invasive Beatmung, die Volumentherapie, aber auch die Nephrotoxizität eingesetzter medikamentöser Therapien.
-
Proteinurie und/oder Hämaturie weisen auf eine Nierenbeteiligung hin, bevor die klassischen Kriterien für eine AKI erfüllt sind.
-
Derzeit existiert keine spezifische Therapie gegen Covid-19-bedingte AKI.
Epidemiologie
Seit über einem Jahr befindet sich die Welt fest im Griff einer Pandemie, ausgelöst durch das „severe acute respiratory syndrome coronavirus 2“ (SARS-CoV-2). Der Name lässt keinen Zweifel am primären Angriffspunkt des Virus. Viele Spekulationen gab es jedoch anfänglich über das Ausmaß, in dem auch andere Organsysteme direkt und indirekt von einer Infektion mit diesem Virus betroffen sein könnten. Den ersten Berichten aus Wuhan zufolge schien SARS-CoV-2 für die Niere kein wesentliches Thema zu sein. Bald folgten jedoch Studien, die wesentlich höhere Inzidenzzahlen für akute Nierenschädigung („acute kidney injury“; AKI) aufzeigten, sodass sich letztendlich eine Streubreite von 1 bis 46% ergab.1 Zudem zeigten sich teils große regionale Unterschiede. In einer Metaanalyse zeigte sich in den USA und Europa eine Inzidenz von 28,6%, während im asiatischen Raum Inzidenzen von 5,5% für hospitalisierte Covid-19-Patienten beobachtet wurden.2 Von noch höheren Inzidenzzahlen darf bei kritisch kranken Covid-19-Patienten ausgegangen werden.3 So fanden Gupta et al. in einer großen multizentrischen Studie eine Inzidenz von 42,8% für die akute Nierenschädigung bei Covid-19-Patienten auf Intensivstationen. In einer Auswertung der Patienten der 1. Covid-19-Welle aus dem Tiroler Covid-19-Intensivmedizin-Register konnten wir eine AKI-Rate von 48,6% beobachten. Eine Nierenersatztherapie („renal replacement therapy“; RRT) wurde in ca. 20% der Fälle benötigt.4 Interessanterweise zeigte sich in der Analyse der 2. Welle, dass die AKI-Rate mit 28% im Verlauf deutlich abnahm (Mayerhöfer T; in submission). Gestützt werden diese Ergebnisse von ähnlichen Beobachtungen aus New York, wo ebenfalls im Verlauf der Pandemie eine abnehmende Rate an AKI beobachtet wurde.5 Auf mögliche Gründe für diese Entwicklung soll im Folgenden noch genauer eingegangen werden. Ungewöhnlich häufig scheint die Covid-19-assoziierte AKI auch bis zum Stadium der Nierenersatztherapiepflicht fortzuschreiten. In der oben erwähnten Studie von Gupta et al. wurde sie mit einer Häufigkeit von ca. 21% bei kritisch kranken Covid-19-Patienten beschrieben.6 Dies ging mit einer hohen Mortalität von 63% einher, wobei von den überlebenden Patienten 34% weiterhin auf eine Dialyse angewiesen waren.
Pathophysiologie
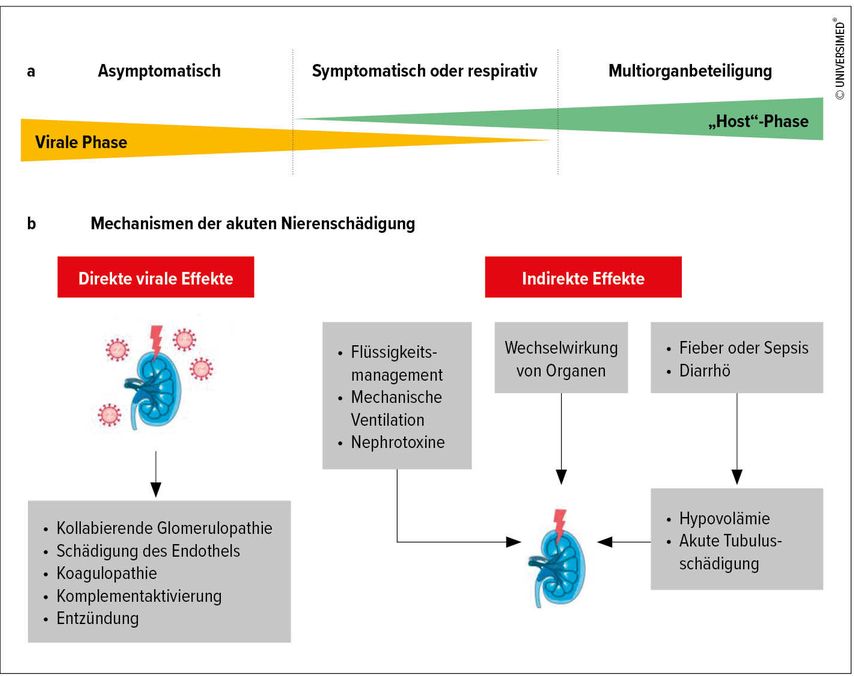
Bei der Pathophysiologie der akuten Nierenschädigung müssen verschiedene auslösende Mechanismen in Betracht gezogen werden. Dabei kann zwischen direkten und indirekten Faktoren unterschieden werden (Abb. 1)7. Als direkte Auswirkung wäre der Befall der Niere mit SARS-CoV-2 zu verstehen, auch als renaler Tropismus bezeichnet. Zu den indirekten Faktoren zählen die Reaktion der Niere auf die SARS-CoV-2-getriggerte Immunantwort mit lokaler und/oder systemischer Entzündungsreaktion, die systemische Hyperkoagulabilität, aber auch die Folgen einer Behandlung auf der Intensivstation, wie hämodynamische Effekte einer invasiven Beatmung, Volumendepletion oder Volumenüberladung, Sepsis oder die Verabreichung nephrotoxischer Medikamente.
Abb. 1: Die Pathogenese der akuten Nierenschädigung bei Covid-19-Patienten (Covid-19-AKI) ist multifaktoriell, wobei sowohl direkte Effekte von SARS-CoV-2 auf die Niere als auch indirekte Mechanismen eine Rolle spielen. Diese sind zum Teil Folge von systemischen Einflüssen der viralen Infektion, Effekte des Virus auf verschiedene Organsysteme wie die Lunge oder Folge der intensivmedizinischen Maßnahmen (modifiziert nach Nadim MK et al. 2020)7
Renaler Tropismus von SARS-CoV-2
SARS-CoV-2 bindet über ACE2-Rezeptoren an die Zelle. Mithilfe der transmembranen Serinproteinase 2 (TMPRSS2) erfolgt schließlich die Aufnahme in die Zelle, mit nachfolgender intrazellulärer Replikation des Virus. ACE2-Rezeptoren lassen sich in der Niere sowohl in den proximalen Tubuluszellen als auch den Podozyten nachweisen, was einen renalen Tropismus mit einer direkten Infektion der Niere prinzipiell möglich erscheinen lässt.8 Verschiedene Autopsiestudien konnten Virus-RNA direkt in der Niere nachweisen.9 Ein Virusnachweis war mit dem Auftreten einer akuten Nierenschädigung und mit dem Schweregrad der Erkrankung assoziiert, was für eine relevante direkte Schädigung der Niere durch SARS-CoV-2 sprechen könnte.10 Allerdings wird die für die Internalisierung von SARS-CoV-2 notwendige Protease TMPRSS2 zwar im distalen Tubulus, aber kaum im proximalen Tubulus bzw. den Podozyten exprimiert.9 Darüber hinaus gelang bislang kein einziger direkter Virusnachweis in Nierenbiopsien von Covid-19-Patienten mit akuter Nierenschädigung.11,12
Das Spektrum der in diesen Biopsien nachgewiesenen histopathologischen Veränderungen reichte von Myoglobinausfällungen in den Nierentubuli, wie sie für Rhabdomyolyse typisch sind, über kollabierende Glomerulosklerose bis hin zur thrombotischen Mikroangiopathie (TMA). Am häufigsten fand sich jedoch eine akute Tubulusnekrose (ATN). Insgesamt sprechen diese Befunde gegen eine für die Pathophysiologie relevante, virale Infektion der Niere und für eine bereits vermutete multifaktorielle Ätiologie der akuten Nierenschädigung bei Covid-19.7,11, 13, 14
Endotheliale Dysfunktion und die Rolle des Zytokinsturms
Im Rahmen der systemischen Immunantwort werden zahlreiche inflammatorische Zytokine freigesetzt, von denen einige, wie z.B. IL-6, in direktem Zusammenhang mit einer akuten Nierenschädigung stehen.15 Oftmals wird in diesem Zusammenhang von einem „Zytokinsturm“ gesprochen.
Obwohl die IL-6-Spiegel bei Covid-19 zwar erhöht sind, scheint diese Erhöhung im Vergleich – sowohl zu anderen ARDS-Ursachen als auch zu der bakteriellen Sepsis – eher gering auszufallen.16,17 Diese Beobachtungen bei SARS-CoV-2 konnten auch durch eine frühe Metaanalyse bestätigt werden, wodurch die Bedeutung des sogenannten „Zytokinsturms“ auch im Hinblick auf die Pathophysiologie der akuten Nierenschädigung bei Covid-19 in den Hintergrund rückt.18
Trotzdem dürften verschiedene andere Zytokine und die Komplementaktivierung eine Rolle als Mitverursacher der endothelialen Dysfunktion spielen. Hier gibt es zudem Hinweise, dass SARS-CoV-2 zur Endothelzellschädigung führt, was zusammen mit anderen, teilweise noch nicht geklärten Mechanismen zu einer Hyperkoagulabilität führt.19 Dies fördert die Ausbildung von arteriellen und venösen Thrombosen, aber auch von Mikrothromben, wie sie vor allem in der Lunge, aber auch in anderen Organen gefunden wurden.20 Laborchemisch zeigt sich dies vor allem durch erhöhte D-Dimer-Werte, die mit einer erhöhten Mortalität assoziiert sind.21 In der Niere können Mikrothromben als mögliche Mitverursacher der akuten Nierenschädigung bei Covid-19 durch Perfusionsstörungen im Kortex, aber vor allem in der Medulla in Betracht gezogen werden. Die in Nierenbiopsien erhobenen Befunde von TMA unterstützen diese Annahme.
Der genaue Mechanismus der durch SARS-CoV-2 hervorgerufenen Endothelzellschädigung ist noch nicht endgültig geklärt. Tierexperimentelle Daten weisen auf eine direkte Endothelschädigung durch die Bindung des Spike-Proteins an den ACE2-Rezeptor hin.22 Als ein alternativer Mechanismus wird die Bildung von Autoantikörpern gegen den ACE2-Rezeptor im Rahmen der Immunantwort gegen das Spike-Protein von SARS-Cov-2 diskutiert.23
Einfluss der invasiven Beatmung
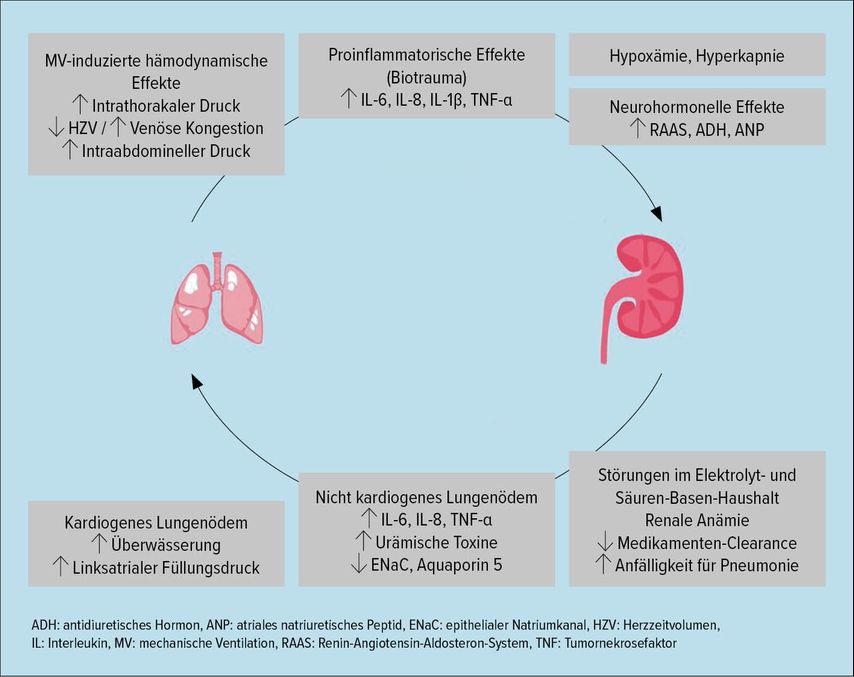
Neben den genannten pathophysiologischen Aspekten sind auch die Auswirkungen von maschineller Beatmung in die Überlegungen mit einzubeziehen.24 Invasive maschinelle Beatmung kann bereits unabhängig von anderen Faktoren eine Beeinträchtigung der Nierenfunktion nach sich ziehen. So führen hohe Beatmungsdrücke zu erhöhten intrathorakalen und -abdominellen Drücken, Rechtsherzbelastung mit venöser Kongestion und einem verminderten Herzzeitvolumen, was direkte hämodynamische Auswirkungen auf die Nierenperfusion hat (Abb. 2).24 Hinzu kommen neurohormonelle Effekte, unter anderem durch die Freisetzung von antidiuretischem Hormon (ADH) und Unterdrückung des atrialen natriuretischen Peptids (ANP). In dieser Konstellation sind eine Abnahme des renalen Blutflusses, der GFR und eine vermehrte Flüssigkeitsretention zu beobachten. Komplizierend zeigt sich bei Covid-19-Patienten eine – auch für Intensivpatienten – außergewöhnlich hohe „Acute respiratory distress syndrome“-(ARDS)-Inzidenz. Hierdurch ist oftmals eine Beatmung mit hohem „positive end-expiratory pressure“ (PEEP) notwendig. Gleichzeitig kommt es zu einer durchschnittlich sehr langen Beatmungsdauer.4 Hier fallen die erwähnten Faktoren deutlich schwerer ins Gewicht als bei eher kurzfristigen Beatmungstherapien, wie beispielsweise bei postoperativen Patienten, welche meist rasch vom Respirator entwöhnt werden können. Diesem Konzept entsprechend, trat eine AKI unter nichtinvasiver Beatmung (NIV) in Tirol deutlich seltener auf als unter invasiver Beatmung (10,2% vs. 50,9%), wie wir anhand der Analyse des Tiroler Covid-19-Intensivmedizin-Registers zeigen konnten (Mayerhöfer T; in submission).
Abb. 2: Mechanismen, die zu einer gegenseitigen Verschlechterung der Organfunktion von Lunge und Niere führen können (modifiziert nach Klein SJ et al. 2018)24
Einfluss der Volumentherapie
Am Beginn der ersten Welle wurde auf Grundlage der Covid-19-Guidelines der „surviving sepsis campaign“ ein restriktives Flüssigkeitsregime bei Patienten mit Covid-19-assoziierter Sepsis und/oder ARDS empfohlen.25 Ein gewisser Übereifer bei der Adhärenz zu diesen Empfehlungen dürfte zu einer hohen Rate von iatrogener „Volumendepletion“ geführt haben, die eine aufgrund der akuten Viruserkrankung bereits vorhandene Hypovolämie noch verstärkt hat und damit wesentlich zur hohen Inzidenz von AKI bei kritisch kranken Patienten beigetragen hat. Später änderte sich die allgemeine Strategie in Richtung einer initial großzügigeren Flüssigkeitsgabe bis zur hämodynamischen Stabilisierung der Patienten, während ein restriktives Regime erst für die spätere Phase des ARDS empfohlen wird.
Nephrotoxizität
Die Therapie der vermehrt auftretenden bakteriellen Superinfektionen/Sepsis bei der schweren Covid-19-Erkrankung erfordert oftmals den Einsatz von Antibiotika mit einem relevanten nephrotoxischen Potenzial (Aminoglykoside, Vanomycin, Colistin).
Nicht auszuschließen sind außerdem nephrotoxische Effekte durch die verschiedenen, teils sogar in Kombination eingesetzten experimentellen Therapien in der Frühphase der Pandemie. Während Hydroxychloroquin mittlerweile keine Rolle mehr in der Therapie von Covid-19 spielt, wurde dieses trotz schlechter Datenlage, aufgrund fehlender Alternativen, zu Beginn breit eingesetzt.26 Während systematische Daten fehlen, gibt es verschiedene Mechanismen, durch die eine Schädigung der Niere durch Hydroxychloroquin denkbar wäre.27 Berichte über eine mögliche erhöhte Rate von AKI existieren außerdem zu Ritonavir/Lopinavir aus Pharmakovigilanzdaten.28 Für Remdesivir gilt, dass trotz eines erhöhten AKI-Risikos auf Basis von Pharmakovigilanzdaten der WHO, der Einsatz beim akuten und chronischen Nierenversagen zumindest für eine kurzfristige Anwendung laut ersten Studiendaten sicher zu sein scheint.29,30 Vor allem für experimentelle Therapien ohne wirkliche Datengrundlage sollten potenzielle Interaktionen und eine denkbare Nephrotoxizität in eine individuelle Risiko-Nutzen-Analyse stets miteinbezogen werden.
Als ein weiterer, von Medikamenten weitgehend unabhängiger Mechanismus für AKI ist außerdem eine bei Viruserkrankungen häufig zu beobachtende Rhabdomyolyse in Betracht zu ziehen.31
Diagnose der Covid-19-assoziierten AKI
Neben den Parametern für die Diagnose einer akuten Nierenschädigung nach den KDIGO-Kriterien (Serumkreatinin oder Oligurie) scheinen – vor allem bei der frühen Diagnose der akuten Nierenschädigung – Urinanalysen wegweisend zu sein. In einer rezenten Arbeit zu hospitalisierten Patienten mit einer akuten Nierenschädigung und Covid-19 konnte bei 84% eine Proteinurie und bei 81% eine Hämaturie nachgewiesen werden.32 Diese Veränderungen waren wesentlich häufiger als die nach den KDIGO-Kriterien gestellte Diagnose AKI (46%). Die Urinveränderungen weisen also auf eine akute Nierenbeteiligung hin, bevor die klassischen Kriterien für eine AKI erfüllt sind. Dem wird auch in dem kürzlich veröffentlichten Konsensus-Statement zum neuen Staging des AKI mit der Stufe AKI Stadium 1S (Biomarkerpositiv, Serum-Kreatinin und Oligurie negativ) Rechnung getragen und sollte auch bei Covid-19-Patienten berücksichtigt werden.33
Therapie der Covid-19-assoziierten AKI
Derzeit existiert keine spezifische Therapie gegen Covid-19-bedingte AKI. Inwiefern antivirale Strategien in der Frühphase der Erkrankung, vor allem im Hinblick auf den potenziell mitauslösenden renalen Tropismus eine Rolle in der Therapie und Vermeidung der akuten Nierenschädigung bei Covid-19 spielen, ist noch unbekannt.34
Da die Immunantwort in der Pathophysiologie des AKI bei Covid-19 eine wichtige Rolle spielen dürfte, könnte eine immunmodulierende Therapie ein geeigneter Angriffspunkt sein. Interessanterweise zeigte sich im RECOVERY-Trial eine reduzierte Rate von RRT bei Patienten, welche mit Dexamethason behandelt wurden (4,4% vs. 7,5%).26 Eine weitere Studie der RECOVERY-Gruppe untersuchte die Kombination aus Dexamethason (D) und Tocilizumab (T) und konnte wiederum eine reduzierte Notwendigkeit von RRT (5% in der D+T-Gruppe im Vergleich zu 7% in der D-Gruppe) zeigen.35 Bemerkenswert ist jedoch die Tatsache, dass in letzterer Studie die Inzidenz von RRT in der Dexamethason-Gruppe genauso hoch war wie in der Kontrollgruppe der ersten RECOVERY-Studie. Somit lässt sich die Wirksamkeit von Tocilizumab im Sinne einer Nephroprotektion derzeit nicht abschließend beantworten.
Da bei der Pathophysiologie der AKI bei Covid-19 potenziell auch die erwähnten Mikrothromben im Zusammenhang mit einer Koagulopathie als Ursache in Betracht kommen, ist eine adäquate Antikoagulationsstragie zur Vermeidung dieser Komplikation von Bedeutung.
In der kürzlich publizierten INSPIRATION-Studie, die verschiedene Antikoagulationsstrategien verglichen hat, zeigten sich jedoch keine signifikanten Unterschiede in Bezug auf die Häufigkeit von RRT.36 Somit empfiehlt sich weiterhin eine auf die individuellen Risikofaktoren abgestimmte Antikoagulation.
Eine große Bedeutung ist der AKI-Prophylaxe beizumessen. Diese beinhaltet unter anderem eine Optimierung der renalen Perfusion durch adäquate Volumenkontrolle. Zwar sollte eine Hypovolämie zu Beginn rasch korrigiert werden, im Verlauf sind dann jedoch ein ausgeglichener Flüssigkeitshaushalt und das Vermeiden einer Volumenüberladung und nachfolgender venöser Kongestion anzustreben.37 Dies ist vor allem auch im Hinblick auf eine adäquate Covid-19-ARDS-Therapie von entscheidender Bedeutung. Des Weiteren sollten im Sinne einer lungenprotektiven Beatmung die Beatmungsdrücke – sofern möglich – reduziert werden, was sich auch positiv auf die Niere auswirkt.38
Bei Patienten, welche eine schwere AKI entwickeln, sollten die derzeit gültigen Kriterien für eine Nierenersatztherapie angewandt werden.39
Zusammenfassung
Die Covid-19-assoziierte Nierenschädigung ist häufig. Es hat sich gezeigt, dass verschiedene Mechanismen für das Auftreten einer akuten Nierenschädigung unter Covid-19 verantwortlich sind. Neben einem potenziellen renalen Tropismus von SARS-CoV-2 spielen vor allem systemische Auswirkungen der Viruserkrankung und bei kritisch erkrankten Patienten intensivmedizinische Interventionen, bakterielle Superinfektionen, Volumentherapie und Nephrotoxine eine entscheidende Rolle bei der Entstehung der AKI. 1617
Literatur:
1 Farouk SS et al.: J Nephrol 2020; 33(6): 1213-8 2 Fu EL et al.: Clin Kidney J 2020; 13(4): 550-63 3 Yang X et al.: Int Immunopharmacol 2021; 90:107159 4 Klein SJ et al.: Wien Klin Wochenschr 2020; 132: 653-63 5 Charytan DM et al.: Kidney Int Rep 2021; 6(4): 916-27 6 Gupta S et al.: J Am Soc Nephrol 2021; 32(1): 161 7 Nadim MK et al.: Nat Rev Nephrol 2020; 16(12): 747-64 8 Pan X-W et al.: Intensive Care Med 2020; 46(6): 1114-6 9 Puelles VG et al.: N Engl J Med 2020; 383(6): 590-2 10 Braun F et al.: Lancet 2020; 396: 1881-2 11 Sharma P et al.: J Am Soc Nephrol 2020; 31(9): 1948 12 Kudose S et al.: J Am Soc Nephrol 2020; 31(9): 1959 13 Bradley BT et al.: Lancet 2020; 396: 320-32 14 Santoriello D et al.: J Am Soc Nephrol 2020; 31(9): 2158-67 15 Su H et al.: Front Immunol 2017; 8: 405 16 Sinha P et al.: JAMA Internal Medicine 2020; 180: 1152-4 17 Kox M et al.: JAMA 2020; 324(15): 1565-7 18 Leisman DE et al.: Lancet Respir Med 2020; 8(12): 1233-44 19 Lowenstein CJ, Solomon Scott D: Circulation 2020; 142(17): 1609-11 20 Menter T et al.: Histopathology 2020; 77(2): 198-209 21 Zhou F et al.: Lancet 2020; 395(10229): 1054-62 22 Nuovo GJ et al.: Ann Diagn Pathol 2021; 51: 151682 23 Casciola-Rosen L et al.: medRxiv 2020; doi: 10.1101/2020.10.13.20211664 24 Klein SJ et al.: Med Klin Intensivmed 2018; 113: 448-55 25 Alhazzani W et al.: Intensive Care Med 2020; 46(5): 854-87 26 Suleyman G et al.: JAMA Netw Open 2020; 3(6): e2012270 27 Edelstein CL et al.: Kidney Int 2020; 98(1): 234-5 28 Binois Y et al.: Kidney Int Rep 2020; 5(10): 1787-90 29 Gérard AO et al.: Clin Pharmacol Ther 2021; 109(4): 1021-4 30 Thakare S et al.: Kidney Int Rep 2020; 6(1): 206-10 31 Joannidis M, Forni LG: Intensive Care Med 2011; 37(5): 729-31 32 Chan L et al.: J Am Soc Nephrol 2021; 32(1): 151-60 33 Ostermann M et al.: JAMA Netw Open 2020; 3(10): e2019209 34 Beigel JH et al.: N Eng J Med 2020; 383(19): 1813-26 35 Group RC: Lancet 2021; 397: 1637-45 36 INSPIRATION Investigators: JAMA 2021; 325(16): 1620-30 37 Joannidis M et al.: Med Klin Intensivmed 2018: 113: 358-69 38 Ranieri VM et al.: JAMA 2000; 284(1): 43-4 39 Klein SJ, Joannidis M: Med Klin Intensivmed 2018; 112: 437-43