Welche Substanzen könnten sich als Gamechanger erweisen?
Bericht:
Mag. Dr. Anita Schreiberhuber
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Ein spannender Vortrag zum Thema „New drugs on the horizon“ fand am letzten Tag der UEG (United European Gastroenterology)Week in Wien statt. Darin wurden der Stellenwert der bislang verfügbaren Substanzen, deren Weiterentwicklung in Richtung höherer Selektivität und besserer Verträglichkeit sowie neue Substanzen erörtert, die potenziell die Therapielandschaft bei chronisch-entzündlichen Darmerkrankungen erweitern und bereichern können.
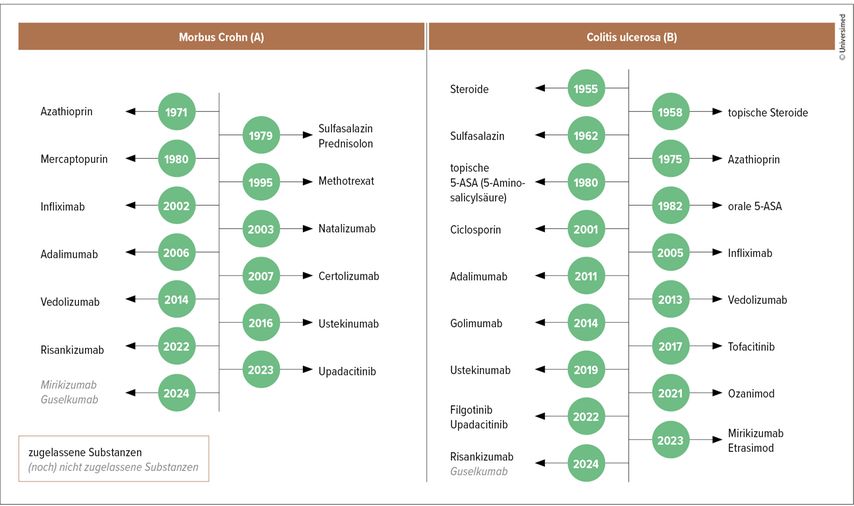
Nachdem zwischen 2017 und 2020 gewissermaßen eine Stagnation zu verzeichnen war, ist im Laufe der vergangenen Jahre – insbesondere für Colitis ulcerosa (CU) – eine beachtliche Anzahl an Substanzen zur Zulassung gekommen“, konstatierte Dr. Sreedhar Subramanian, Cambridge University Hospitals NHS Foundation Trust, UK, der ein Update über den Status quo und in Entwicklung befindliche Medikamente in der Therapie von chronisch-entzündlichen Darmerkrankungen („inflammatory bowel diseases“; IBD) gab (Abb. 1). Erst vor Kurzen hat er mit Kolleg:innen ein Review publiziert, in dem die rezenten und aktuellen Entwicklungen übersichtlich dargestellt sind (Abb. 2).1
Abb. 1: Subramanian brachte im Rahmen der UEG Week in der Messe Wien eine ausgezeichnete Zusammenfassung über die Entwicklung der CED-Medikamente
Abb. 2: Zeitspanne für die Zulassung von Therapien für Morbus Crohn und Colitis ulcerosa (modifiziert nach Noor NM et al.2024)1
Anti-TL1A-Antikörper
„Seit zwei Jahrzehnten wird versucht, das ,TNF-like‘ Zytokin 1A (TL1A) als Zielstruktur zu inhibieren, das wie der Tumornekrosefaktor (TNF) bei vielen Krankheitsentitäten untersucht wird“, berichtete Subramanian, der in dieser Substanzklasse insbesondere den monoklonalen Antikörper Tulisokibart als vielversprechende Substanz hervorhob. Es wird davon ausgegangen, dass dieses Molekül entscheidende modulatorische Signalwege inhibiert, die in Inflammation und Fibrosierung involviert sind.1
Die Ergebnisse aus Phase-II-Studien zu MC2 (Morbus Crohn) und CU3 sind jedenfalls ermutigend: In der Studie zu CU mit vortherapierten Patient:innen (davon hatten 50% bereits fortgeschrittene Therapien erhalten) wurde Tulisokibart in zwei Kohorten untersucht: In Kohorte 2 wurden ausschließlich Patient:innen mit positivem Gentest eingeschlossen (n=43), bei denen man davon ausging, dass sie eine erhöhte Wahrscheinlichkeit für ein Ansprechen zeigen würden, Kohorte 1 umfasste Patient:innen unabhängig vom genetischen Status (n=135). Die Patient:innen wurden im 1:1:1-Design zum Erhalt von Tulisokibart (1000 bzw. 500mg am Tag 1 und in den Wochen 2, 6 und 10) bzw. Placebo (PBO) randomisiert. Der Unterschied im primären Endpunkt, der klinischen Remission (CR), war zwischen Kohorte 1 vs. PBO bzw. Kohorte 2 vs. PBO nicht so groß wie erwartet und betrug 26% vs. 1% bzw. 32% vs. 11%. Subramanian mutmaßte, dass die nicht so ausgeprägte Differenz auf den Placeboeffekt in Kohorte 2 zurückzuführen sein könnte. Auch die Ergebnisse zu den sekundären Endpunkten in Bezug auf die PBO-Response waren ähnlich.3 Nun bleibt abzuwarten, wie die Phase-III-Studienergebnisse ausfallen werden. Die Phase-III-Studien zu MC (NCT064300801) und CU (NCT06052059) sind bereits im Gange.
ABX464 (Obefazimod) – Upregulation von MiR
Als wirklicher Gamechanger könnte sich ABX464 erweisen – dieses orale „First-in-class“-Molekül moduliert auf selektive Weise die Hochregulierung der antiinflammatorisch wirksamen MicroRNA 124 (MiR124). In vitro führte die Upregulation von MiR124 zu einer Reduktion von proinflammatorischen Zytokinen einschließlich der Interleukine (IL), die maßgeblich an Entzündungsprozessen beteiligt sind, wie IL-17 und wirkt demnach gewissermaßen als „physiologische Inflammationsbremse“.4 In der doppelblinden, 48-wöchigen Phase-IIb-Studie mit CU-Patient:innen wurde auch das ProofofConcept erbracht, indem nicht nur eine ausgezeichnete Wirksamkeit, sondern auch eine gute Verträglichkeit nachgewiesen wurden. Patient:innen mit moderater bis schwerer CU und Resistenz gegen oder Nichtansprechen auf die vorangegangene Therapie wurden im 1:1:1:1-Design zu drei verschiedenen Dosen ABX464 (100, 50 bzw. 25mg 1x täglich) bzw. PBO randomisiert. Alle Dosierungen von ABX464 führten vs. PBO zu einer signifikanten Krankheitsverbesserung, gemessen am modifizierten Mayo Score in Woche 8 (primärer Endpunkt). Als häufigste Nebenwirkung (AE) wurden Kopfschmerzen dokumentiert.5 Die Substanz wird derzeit in der Phase-III-Studie ABTEXT-1 (NCT05507203) in den Dosierungen 50 und 25mg vs. PBO weiter untersucht.
Guselkumab bei MC und CU
Im Gegensatz zu den neuen Mechanismen, die bisher erwähnt worden sind, ist der Wirkmechanismus des humanen, gegen IL-23 gerichtetenAntikörpers Guselkumab6 aus den bereits zugelassenen Indikationen Psoriasis und Psoriasis-Arthritis bereits bekannt, aber Guselkumab ist auch bei CU und MC effektiv, wie in den Studien QUASAR7,8 und GALAXI-2 und -39 bestätigt worden ist. In der Indikation CU wurde die Substanz von der US-amerikanischen FDA (Food and Drug Administration) bereits im September 2024 zugelassen,10 die EMA(European Medicines Agency)-Zulassung erfolgt erfahrungsgemäß einige Monate später.
JAK- und TYK2-Inhibitoren
Einige JAK-Inhibitoren (JAK-I) für die Behandlung von IBD befinden sich in der Pipeline, wobei Subramanian Brepocitinib besonders hervorhob, da es teilweise an JAK1, insbesondere aber an Tyrosinkinase2 (TYK2) ansetzt. Das „small molecule“ wird gemeinsam mit Ritlecitinib in der 64 Wochen dauernden Phase-IIa-Studie PIZZICATO vs. PBO an 244 MC-Patient:innen mit inadäquatem Ansprechen oder Verlust des Ansprechens auf bzw. Intoleranz von Kortikosteroiden, Immunsuppressiva oder Biologika geprüft. Für Brepocitinib wurde eine statistische Signifikanz vs. PBO in Woche 12 in den folgenden Endpunkten nachgewiesen: CDAI(Crohn’s Disease Activity Index)-Verbesserung, Remission gemäß CDAI (CDAI <150), CDAI-100-Response und klinisches Ansprechen und Remission von Diarrhö und Abdominalschmerzen. Auch die Verträglichkeit innerhalb dieser sehr kurzen Zeit wurde als akzeptabel eingestuft.11
„Noch viel interessanter sind selektive TYK2-Inhibitoren, die in der Dermatologie bereits zum Einsatz kommen. TYK2-I weisen noch ein besseres Sicherheitsprofil auf, weil sie mit weniger Signalwegen interferieren“, berichtete Subramanian und erklärte, dass es zwei Arten von TYK2-I gibt: orthosterische und allosterische TYK2-I, wobei nur die allosterischen TYK2-I hochselektiv sind. Als vielversprechenden TYK2-I nannte Subramanian TAK-279 (Zasocitinib). Dieser Tyrosinkinase-Inhibitor wird bereits im Rahmen von Phase-II-Studien vs. PBO in den Indikationen MC (NCT06233461) und CU (NCT06254950) untersucht.
S1P1-Modulatoren können hochselektiv sein
Bei den Wirkstoffen dieser Substanzklasse muss ebenfalls eine klare Unterscheidung danach getroffenwerden, wie viele Targets sie blockieren: Während Ozanimod am Sphingosin-1-Phosphat-Rezeptor 5 (S1PR5) und S1PR1 und Etrasimod an S1PR5, S1PR4 und S1PR1 ansetzt, ist Tamuzimod hoch selektiv für S1PR1 und gilt demnach als Hoffnungsträger auch hinsichtlich der Verträglichkeit. Bereits die ersten Phase-II-Daten in der Indikation CU für den primären Endpunkt, die CR-Rate am Ende der Induktionsphase in Woche 13, waren vielversprechend: Tamuzimod war mit CR-Raten von 28% unter der 60mg-Dosis und 24% unter der 30mg-Dosis der PBO-Gruppe mit 11% signifikant überlegen (p=0,018 bzw. p=0,014).12 Die Ergebnisse zur Erhaltungsphase in Woche 52 waren ebenso überzeugend: Die CR-Raten waren mit 50 bzw. 50 vs. 18,2% unter PBO in beiden Dosierungen gleich, die Raten an endoskopischer Remission beliefen sich auf 43,8 (30mg) bzw. 46,1 (60mg) vs. 18,2%. Auch die Verträglichkeit wurde weiterhin als gut beurteilt.13
Kombinationstherapien
Mit Spannung erwartet werden die Ergebnisse der Studien DUET-CD und DUET-UC (NCT05242471 und NCT05242484), in denen erstmals die Kombinationen von zwei monoklonalen Antikörpern – dem TNFα-Inhibitor Golimumab mit dem Anti-IL-23-Antikörper Guselkumab – in Induktions- und Erhaltungsphasen getestet werden. In beiden Studien werden die Patient:innen zu einer der folgenden sechs Gruppen randomisiert: PBO, Guselkumab, Golimumab, Guselkumab+Golimumab „hohe Dosis“, Guselkumab+Golimumab„mittlere Dosis“ oder Guselkumab+Golimumab „niedrige Dosis“.
Darüber hinaus befinden sich viele bispezifische Antikörper in klinischer Entwicklung. So wird beispielsweise Lutikizumab als intravenöse und subkutane Applikation vs. Adalimumab im Head-to-Head-Vergleich in einer Phase-II-Studie (NCT06257875) bei CU-Patient:innen geprüft.
Fazit
„Nicht alle ermutigenden Studienergebnisse, die wir gesehen haben, haben zu einem Durchbruch der jeweiligen Substanz geführt“, machte Subramanian auf die Tatsache aufmerksam, dass beachtenswerte Phase-II-Daten nicht zwangsläufig erfolgversprechend für positive Phase-III-Daten sind, wie man das beim TLR9-Agonisten Cobitolimod gesehen hat: Die Substanz führte in der Phase-II-Induktionsstudie CONDUCT bei Patient:innen mit linksseitig lokalisierter CU zu überzeugenden Ergebnissen hinsichtlich Wirksamkeit und Verträglichkeit.14 Die Phase-III-Studie CONCLUDE (NCT04985968) wurde jedoch vorzeitig abgebrochen, weil das unabhängige Datenüberwachungskomitee zu dem Schluss gekommen ist, dass der primäre Endpunkt einer signifikant höheren CR-Rate vs. PBO in Woche 52 sehr wahrscheinlich nicht erreicht werden würde.15
Von „more of the same“ sprach Subramanian in Bezug auf die Tatsache, dass sich einige Präparate aus bereits bekannten Substanzklassen wie weitere JAK-I und S1P1-Modulatoren in klinischer Entwicklung befinden, was er insofern gerechtfertigt sieht, als diese mit einer besseren Verträglichkeit einhergehen als die gegenwärtig verfügbaren.
Quelle:
Session „What’s new in IBD in 2024?“, Vortrag „New drugs on the horizon“, am 15. Oktober im Rahmen der UEG Weekin Wien
Literatur:
1 Noor NM et al.: Review article: Novel therapies in inflammmatory bowel disease – an update for clinicians. Aliment Pharmacol Ther 2024; 60: 1244-60 2 Feagan BG et al.: DOP87 the anti-TL1A antibody PRA023 demonstrated proof-of-concept in Crohn’s disease: phase 2a APOLLO-CD study results. J Crohns Colitis 2023; 17(1): i162-4 3 Sands BE et al.: Phase 2 trial of anti-TL1A monoclonal antibody tulisokibart for ulcerative colitis. N Engl J Med 2024; 391: 1119-29 4 Apolit C et al.: ABX464 (obefazimod) upregulates miR-124 to reduce proinflammatory markers in inflammatory bowel diseases. Clin Transl Gastroenterol 2023; 14: e00560 5 Vermeire S et al.: ABX464 (obefazimod) for moderate-to-severe, active ulcerative colitis: a phase 2b, double-blind, randomised, placebo-controlled induction trial and 48 week, open-label extension. Lancet Gastroenterol Hepatol 2022; 7: 1024-35 6 https://www.ema.europa.eu/en/medicines/human/EPAR/tremfya ; zuletzt aufgerufen am 3.11.2024 7 Rubin DT et al.: Cumulative response to guselkumab through week 24 of induction in patients with moderately to severely active ulcerative colitis: results from the phase 3 QUASAR induction study.Am J Gastroenterol 2023; doi: 10.14309/01.ajg.0000953252. 60704.b9 8 Rubin DT et al.: The efficacy of guselkumab as maintenance therapy in patients with moderately to severely active ulcerative colitis: results from the phase 3 QUASAR maintenance study. DDW 2024; Abstract #759 9 Panaccione R et al.: Efficacy and safety of guselkumab therapy in patients with moderately to severely active Crohn’s disease: results of the Galaxi 2 & 3 phase 3 studies. ACR 2024; Abstract # 1136 10 https://www.medcentral.com/gastroenterology/fda-expands-guselkumabs-indication-for-induction-and-maintenance-treatment ; zuletzt aufgerufen am 3.11.2024 11 Vermeire S et al.: OP09 Oral ritlecitinib and brepocitinib in patients with moderate to severe active Crohn’s disease: data from the PIZZICATO umbrella study. J Crohns Colitis 2024; 18(1): i16 12 Sands BE et al.: Efficacy and safety of the oral selective sphingosine-1-phosphate-1 receptor modulator VTX002 in moderately to severely active Ulcerative Colitis: results from a randomised, double-blind, placebo-controlled, phase 2 trial.JCC 2024; 18(1): i4-5 13 Danese S et al.: Efficacy and safety of tamuzimod in moderately to severely active ulcerative colitis through 52 weeks: phase 2 long-term extension data. UEG 2024; Abstract #LB1414 Atreya R et al.: Cobitolimod for moderate-to-severe, left-sided ulcerative colitis (CONDUCT): a phase 2b randomised, double-blind, placebo-controlled, dose-ranging induction trial. Lancet Gastroenterol Hepatol 2020; 5: 1063-75 15 https://www.hcplive.com/view/cobitolimod-phase-3-program-discontinued-for-ulcerative-colitis-treatment ; zuletzt aufgerufen am 3.11.2024
Das könnte Sie auch interessieren:
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...
Zöliakie: Stand der Entwicklungpharmakologischer Therapieoptionen
Viele Patienten mit Zöliakie haben trotz glutenfreier Diät weiterhin Beschwerden. Zurzeit befinden sich einige innovative therapeutische Ansätze in Entwicklung: u.a. ein Inhibitor der ...
Transition bei CED: Fallbeispiel für einen strukturierten Übergang
Die Transition bei chronisch-entzündlichen Darmerkrankungen stellt eine wichtige Brücke zwischen Jugendlichen und Erwachsenen dar und birgt einige Herausforderungen. Am ...